【快譯】Ashes to Ashes 手工皂白粉釋疑
文章出處: Chemistry 101: Ashes to Ashes, by Kevin Dunn
手工製皂者有時會在皂的表面看到一層白色的結晶,我們常稱之為 soda ash (台灣稱之為白粉)。有些人可能以為這個詞裡的 ash 是因為這一層白色物質摸起來很像灰的質感而來,但這事實上要回到工業化學的初始年代。早在大型跨國企業或大型製造工廠出現之前,業界使用的鹼性物質(lye)是透過三種商品的製造過程產生的:玻璃、紙張和肥皂。
最早開始進入商業生產的鹼是鉀鹼 (potash),是透過以水浸木灰的方式提煉製造。之後再將充滿鹼的水在鍋中煮沸到乾,保留在鍋中殘留的白色固體,就叫做 pot-ash 鍋裡的灰。將油脂與鍋裡的灰加在一起煮滾,產生液體皂,再加入鹽轉化為固體的肥皂。後來製皂者發現改煮海藻以代替木灰,產生出來的灰可以直接做成固體皂,不需要再加鹽。這種灰當時叫做蘇打灰 soda ash。
幾個世紀過了,製皂的流程逐漸演進。將石灰石加熱至高溫,變成另一種更便於利用的鹼石灰 lime,之後可以與鉀鹼或蘇打灰結合,以製造更強的鹼 ─ 苛性鉀和苛性鈉。到了十九世紀初期,苛性鈉已經成為新興化學工業最重要的產品,主要用於肥皂生產。時至今日,蘇打灰仍是一項重要的商品,在超市裡面以「洗滌蘇打」出售。
在第一輪的化學工業化過程中,鹼的化學被研究出來。鉀鹼和蘇打灰的成分被檢定出來,分別為碳酸鉀K2CO3,和碳酸鈉 Na2CO3。鹼石灰 lime的成分則是氫氧化鈣 Ca(OH)2。苛性鉀和苛性鈉則分別是氫氧化鉀 KOH和氫氧化鈉 NsOH。將蘇打灰轉換為苛性鈉的化學方程式如下:
Na2CO3 + Ca(OH)2 = CaCO3 + 2 NaOH
請注意在這個化學反應裡面,碳酸鈉和氫氧化鈣這兩個化合物只是交換姓名而已,直接變成碳酸鈣和氫氧化鈉。
手工製皂者仰賴的是氫氧化鈉和油之間的反應,但是對氫氧化鈉與空氣之間的反應比較不熟悉,而這部分的化學,正是瞭解肥皂上的白粉形成的關鍵。要瞭解這個現象,我們要先特地製作一塊不好的肥皂。準備兩個保麗龍咖啡杯,其中一個有蓋,保鮮膜,棕櫚油,氫氧化鈉和水。加一點你最喜歡的深色色料的話,會讓白粉更明顯。秤100g融化的棕櫚油放入第一個杯子裡,加入少許色料。在第二個杯子裡面溶解23g的氫氧化鈉於46g的水裡面。將氫氧化鈉溶液倒入油裡面,接著將杯子表面用保鮮膜蓋住,再把蓋子蓋上密封住。搖動杯子以徹底混合皂液,緊壓蓋子避免漏出。你會聽到並感覺到杯中的皂液越來越濃稠,接近trace的狀態。放置隔夜讓皂化反應完成。這樣做出來的皂會有過量的氫氧化鈉。
第二天打開杯子的時候,皂看起來應該是正常的,但是如果你的操作正確,這杯皂應該是過鹼。要確認這一點,可以在肥皂上面低幾滴酚酞指示劑,顏色應該會呈粉紅色。請注意酚酞指示劑常以酒精溶劑形式販售,這個溶劑正是我們需要的檢測工具。水性溶劑無論如何都會變成粉紅色,無論皂是否過鹼。
要產生出真正的 soda ash,只要把蓋子打開再靜置一天。在這段時間內,空氣中的二氧化碳會跟皂表面過量的氫氧化鈉起反應,如以下方程式所示:
2 NaOH + CO2 = Na2CO3 + H2O
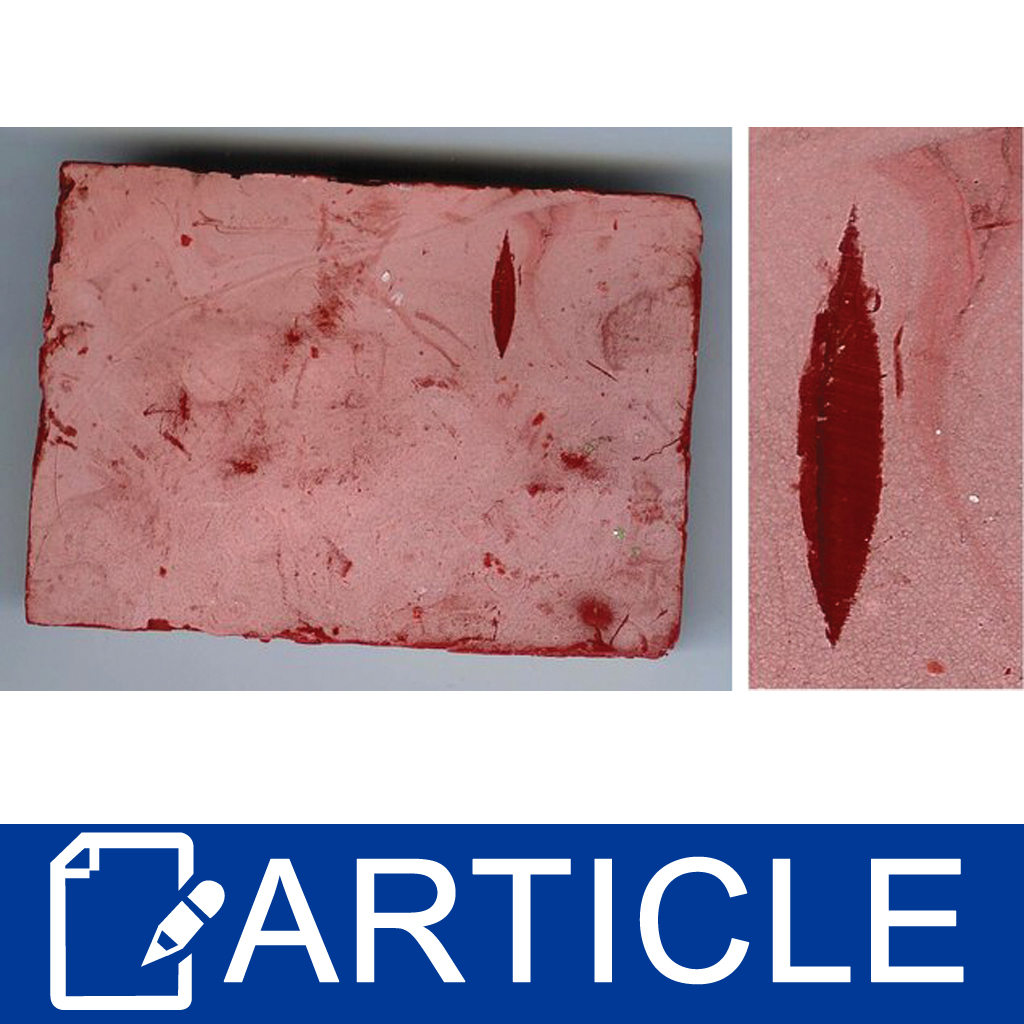
所得到的碳酸鈉在表面形成白色的結晶,就是氫氧化鈉與空氣中的二氧化碳接觸的結果。碳酸鈉跟氫氧化鈉比起來鹼性要弱很多,並不會改變醇基酚酞指示劑的顏色。圖一即為用紅色氧化鐵染色的棕櫚油皂表面形成的白粉。表面的切口露出底下肥皂的顏色。
在正常的沒有過鹼的肥皂上面,白粉又是如何形成的呢?如果肥皂在剛做好的4-8小時內接觸空氣中的二氧化碳,皂的表面尚未反應完全的氫氧化鈉就會變成碳酸鈉。最好的預防方是就是在這期間把肥皂蓋起來。如果你的皂模有蓋子,蓋起來就足夠了。如果沒有,在皂上面蓋一層塑膠/保鮮膜也可以。覆蓋的表面並不一定需要接觸到肥皂表面,只是需要防止新的空氣進入。任何夾在保護塑膠膜/片與肥皂表面的二氧化碳,產生出來的白粉量很少,不太會被注意到。
白粉並不會造成傷害,且因為它非常溶於水,稍微噴水很容易就可去除。但我們特地製作出來的過鹼的皂,白粉則會在新鮮的表面上反覆出現。在你把皂切開的時候,一開始看起來皂的表面很正常,但白粉會逐漸在幾個小時候新形成的切面出現。一直切下去,白粉就會一直出現,直到所有過多的鹼都已經反應完畢。是適合闔家觀賞的小遊戲!
手工製皂者有時會在皂的表面看到一層白色的結晶,我們常稱之為 soda ash (台灣稱之為白粉)。有些人可能以為這個詞裡的 ash 是因為這一層白色物質摸起來很像灰的質感而來,但這事實上要回到工業化學的初始年代。早在大型跨國企業或大型製造工廠出現之前,業界使用的鹼性物質(lye)是透過三種商品的製造過程產生的:玻璃、紙張和肥皂。
最早開始進入商業生產的鹼是鉀鹼 (potash),是透過以水浸木灰的方式提煉製造。之後再將充滿鹼的水在鍋中煮沸到乾,保留在鍋中殘留的白色固體,就叫做 pot-ash 鍋裡的灰。將油脂與鍋裡的灰加在一起煮滾,產生液體皂,再加入鹽轉化為固體的肥皂。後來製皂者發現改煮海藻以代替木灰,產生出來的灰可以直接做成固體皂,不需要再加鹽。這種灰當時叫做蘇打灰 soda ash。
幾個世紀過了,製皂的流程逐漸演進。將石灰石加熱至高溫,變成另一種更便於利用的鹼石灰 lime,之後可以與鉀鹼或蘇打灰結合,以製造更強的鹼 ─ 苛性鉀和苛性鈉。到了十九世紀初期,苛性鈉已經成為新興化學工業最重要的產品,主要用於肥皂生產。時至今日,蘇打灰仍是一項重要的商品,在超市裡面以「洗滌蘇打」出售。
在第一輪的化學工業化過程中,鹼的化學被研究出來。鉀鹼和蘇打灰的成分被檢定出來,分別為碳酸鉀K2CO3,和碳酸鈉 Na2CO3。鹼石灰 lime的成分則是氫氧化鈣 Ca(OH)2。苛性鉀和苛性鈉則分別是氫氧化鉀 KOH和氫氧化鈉 NsOH。將蘇打灰轉換為苛性鈉的化學方程式如下:
Na2CO3 + Ca(OH)2 = CaCO3 + 2 NaOH
請注意在這個化學反應裡面,碳酸鈉和氫氧化鈣這兩個化合物只是交換姓名而已,直接變成碳酸鈣和氫氧化鈉。
手工製皂者仰賴的是氫氧化鈉和油之間的反應,但是對氫氧化鈉與空氣之間的反應比較不熟悉,而這部分的化學,正是瞭解肥皂上的白粉形成的關鍵。要瞭解這個現象,我們要先特地製作一塊不好的肥皂。準備兩個保麗龍咖啡杯,其中一個有蓋,保鮮膜,棕櫚油,氫氧化鈉和水。加一點你最喜歡的深色色料的話,會讓白粉更明顯。秤100g融化的棕櫚油放入第一個杯子裡,加入少許色料。在第二個杯子裡面溶解23g的氫氧化鈉於46g的水裡面。將氫氧化鈉溶液倒入油裡面,接著將杯子表面用保鮮膜蓋住,再把蓋子蓋上密封住。搖動杯子以徹底混合皂液,緊壓蓋子避免漏出。你會聽到並感覺到杯中的皂液越來越濃稠,接近trace的狀態。放置隔夜讓皂化反應完成。這樣做出來的皂會有過量的氫氧化鈉。
第二天打開杯子的時候,皂看起來應該是正常的,但是如果你的操作正確,這杯皂應該是過鹼。要確認這一點,可以在肥皂上面低幾滴酚酞指示劑,顏色應該會呈粉紅色。請注意酚酞指示劑常以酒精溶劑形式販售,這個溶劑正是我們需要的檢測工具。水性溶劑無論如何都會變成粉紅色,無論皂是否過鹼。
要產生出真正的 soda ash,只要把蓋子打開再靜置一天。在這段時間內,空氣中的二氧化碳會跟皂表面過量的氫氧化鈉起反應,如以下方程式所示:
2 NaOH + CO2 = Na2CO3 + H2O
所得到的碳酸鈉在表面形成白色的結晶,就是氫氧化鈉與空氣中的二氧化碳接觸的結果。碳酸鈉跟氫氧化鈉比起來鹼性要弱很多,並不會改變醇基酚酞指示劑的顏色。圖一即為用紅色氧化鐵染色的棕櫚油皂表面形成的白粉。表面的切口露出底下肥皂的顏色。
在正常的沒有過鹼的肥皂上面,白粉又是如何形成的呢?如果肥皂在剛做好的4-8小時內接觸空氣中的二氧化碳,皂的表面尚未反應完全的氫氧化鈉就會變成碳酸鈉。最好的預防方是就是在這期間把肥皂蓋起來。如果你的皂模有蓋子,蓋起來就足夠了。如果沒有,在皂上面蓋一層塑膠/保鮮膜也可以。覆蓋的表面並不一定需要接觸到肥皂表面,只是需要防止新的空氣進入。任何夾在保護塑膠膜/片與肥皂表面的二氧化碳,產生出來的白粉量很少,不太會被注意到。
白粉並不會造成傷害,且因為它非常溶於水,稍微噴水很容易就可去除。但我們特地製作出來的過鹼的皂,白粉則會在新鮮的表面上反覆出現。在你把皂切開的時候,一開始看起來皂的表面很正常,但白粉會逐漸在幾個小時候新形成的切面出現。一直切下去,白粉就會一直出現,直到所有過多的鹼都已經反應完畢。是適合闔家觀賞的小遊戲!


Comments
Post a Comment